細(xì)胞活力的測(cè)定在生命科學(xué)和生物技術(shù)的許多領(lǐng)域都是必不可少的環(huán)節(jié)。傳統(tǒng)上���,細(xì)胞活力通常通過寬視野光學(xué)顯微照片中染色細(xì)胞的半自動(dòng)或自動(dòng)計(jì)數(shù)來確定�����,通常這種檢測(cè)方法需要額外的染色標(biāo)記過程�,故很難作為在線或原位快速檢測(cè)的手段。Ampha Z32微流控阻抗流式細(xì)胞儀(IFC)是一種基于Coulter原理的無需標(biāo)記的單細(xì)胞檢測(cè)技術(shù)�����,可在線快速��、準(zhǔn)確測(cè)定懸浮液中單細(xì)胞的活性狀態(tài)���。Ampha Z32不含光學(xué)元件��,無需調(diào)整和校準(zhǔn)�,便于攜帶�,不僅可在實(shí)驗(yàn)室使用,還同樣適用于實(shí)驗(yàn)室外的檢測(cè)�����。此前��,Ampha Z32多用于花粉質(zhì)量分析�,但目前其也逐步應(yīng)用到細(xì)胞生物學(xué)的許多領(lǐng)域����,如檢測(cè)癌細(xì)胞的活力�����、分化和凋亡(Ampha Z32阻抗流式細(xì)胞儀在癌細(xì)胞狀態(tài)鑒定中的應(yīng)用)�;監(jiān)測(cè)牛紅細(xì)胞寄生蟲感染過程�;成纖維細(xì)胞分化為脂肪細(xì)胞的研究;甚至是納米材料毒性評(píng)估(Ampha Z32阻抗流式細(xì)胞儀在納米材料毒性篩選中的應(yīng)用)等方面��。本文利用Ampha Z32精確并快速的評(píng)估了正常和熱滅活��、發(fā)酵過程中以及長(zhǎng)期好氧間歇培養(yǎng)過程中酵母細(xì)胞的細(xì)胞活力和細(xì)胞狀態(tài)����,并與常規(guī)染色方法進(jìn)行了比較。此外�,還監(jiān)測(cè)了感染桿狀病毒后昆蟲細(xì)胞活性的變化并預(yù)測(cè)了胞內(nèi)蛋白的理想收獲時(shí)間。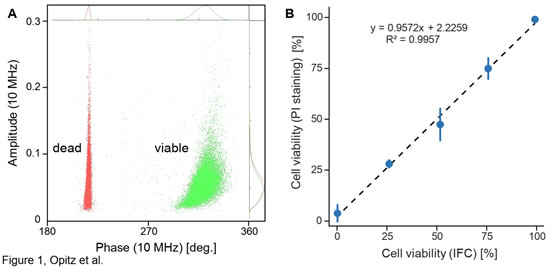
圖1 IFC法與PI熒光染色法測(cè)定的酵母活性的相關(guān)性A)10MHz頻率下釀酒酵母(Scc ATCC 9080)活細(xì)胞(未處理��;綠點(diǎn))和死細(xì)胞(熱處理�;紅點(diǎn))的IFC相位角(x軸)-振幅(y軸)疊加散點(diǎn)圖;B)IFC法(n=3�����,std=0.15%)和染色法(n=3,std=4.4%)的相關(guān)性分析(R2=0.996)IFC法:本實(shí)驗(yàn)中未經(jīng)處理和熱處理的酵母死細(xì)胞樣品按預(yù)定比例(1:0�����、3:1��、1:1���、1:3�����、0:1)混合至100μl�����,之后用AF6緩沖液進(jìn)一步稀釋至2ml���,經(jīng)20μm過濾器過濾后上機(jī)測(cè)試,三次重復(fù)�,細(xì)胞采集數(shù)目設(shè)定為20000。PI法:200μl AF6和100μl 3.0μg/ml碘化丙啶(PI)稀釋100μl上述未經(jīng)處理/熱處理的細(xì)胞混合物,并使用熒光顯微鏡(Leica)計(jì)數(shù)PI染色(死亡)和未染色(存活)細(xì)胞��。實(shí)驗(yàn)結(jié)果表明�,相較于傳統(tǒng)染色鏡檢法,Ampha Z32阻抗流式細(xì)胞儀(IFC)操作簡(jiǎn)單����、測(cè)量快速�����,是一種統(tǒng)計(jì)性��、重復(fù)性�����、測(cè)量精度以及標(biāo)準(zhǔn)化程度都更高的檢測(cè)方法�����。常規(guī)培養(yǎng)下和兩性霉素B(Sigma)處理后釀酒酵母活性的變化
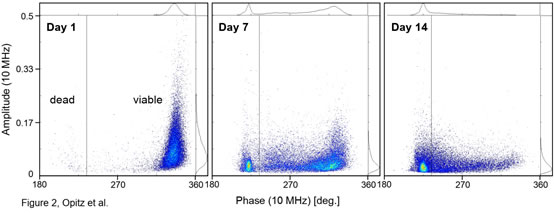
圖2 常規(guī)培養(yǎng)下釀酒酵母(Scc ATCC9080)活性的變化(IFC法)
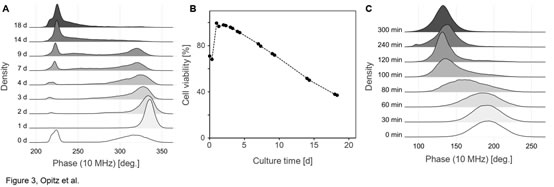
圖3. 常規(guī)培養(yǎng)下和兩性霉素B(Sigma)處理后釀酒酵母活性的變化A)常規(guī)培養(yǎng)下�,釀酒酵母(Scc ATCC 9080)活性相位直方圖隨時(shí)間的變化(10 MHz)。B)酵母活性隨培養(yǎng)時(shí)間的變化曲線�。C)在添加1μg/ml的兩性霉素B后的0-5h內(nèi),釀酒酵母(Scc ATCC 9080)活性相位直方圖的變化釀酒酵母(Scc ATCC 9080)常規(guī)培養(yǎng)����,即250 ml錐形瓶中在28°C的搖動(dòng)培養(yǎng)箱中培養(yǎng)數(shù)天�����,培養(yǎng)基為100 ml YPD����。兩性霉素B(Sigma)處理��,即將常規(guī)培養(yǎng)中處于指數(shù)生長(zhǎng)時(shí)期的釀酒酵母細(xì)胞暴露于1μg/ml的兩性霉素B中�。圖2為接種培養(yǎng)后的第1、7和14天���,釀酒酵母的相位-振幅散點(diǎn)圖的變化��,從圖中可以看出��,在接種培養(yǎng)的第7天出現(xiàn)兩個(gè)明顯可區(qū)分的類群�����。在培養(yǎng)的18天中�,可以清晰看到活性酵母類群的逐漸向低相位和較小振幅移動(dòng)(圖3A),也就是說�,隨著培養(yǎng)時(shí)間的延長(zhǎng),酵母細(xì)胞活性逐漸下降(圖3B)�����。此過程反映了在長(zhǎng)期好氧間歇培養(yǎng)中����,因營(yíng)養(yǎng)限制而導(dǎo)致的酵母細(xì)胞的死亡過程���。圖3C同樣觀察到經(jīng)兩性霉素B(Sigma)處理后���,釀酒酵母細(xì)胞的活性逐漸降低,但這一過程反映的是毒性化合物誘導(dǎo)下酵母細(xì)胞的死亡過程�。這表明IFC還可應(yīng)用于懸浮細(xì)胞的無標(biāo)記毒理學(xué)研究,例如用于IC50值的測(cè)定����。
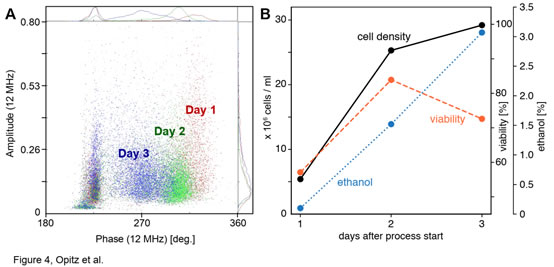
A) 開始發(fā)酵后的前3天,酵母細(xì)胞的相位-振幅散點(diǎn)圖變化�。B) 發(fā)酵過程中的酵母細(xì)胞的密度(黑色)、活力(橙色)和乙醇濃度(藍(lán)色)隨時(shí)間的變化��。啤酒釀造發(fā)酵罐中的生長(zhǎng)條件與前面討論的情況不同,圖4記錄了酵母的發(fā)酵過程�����,開始的第1天(紅色)到第2天(綠色)��,酵母細(xì)胞呈指數(shù)增殖���,細(xì)胞濃度從5.4增加到25.3 x 106細(xì)胞/ml��,細(xì)胞活力從57.1增加到83.9%(圖4B)��。第3天結(jié)束時(shí)���,酵母細(xì)胞(藍(lán)色)移向較低的相角,這意味著細(xì)胞濃度的增長(zhǎng)減慢�����,細(xì)胞活力下降����。而發(fā)酵罐中乙醇濃度從第一天的0.1%迅速增加到第三天的3.1%(圖4B)。這是由于培養(yǎng)第一天細(xì)胞濃度低���、活力低且發(fā)酵罐中仍存在大量氧氣���,當(dāng)發(fā)酵罐中的氧氣全部消耗完后��,酵母轉(zhuǎn)入?yún)捬跻掖及l(fā)酵���,乙醇濃度迅速增加,而乙醇濃度增加又會(huì)對(duì)酵母細(xì)胞產(chǎn)生毒性���,故酵母細(xì)胞活性降低��。IFC的檢測(cè)到的活性相位變化與以上響應(yīng)過程高度一致�。本文利用Ampha Z32(IFC)分別跟蹤了感染和未感染染桿狀病毒(BV)的Sf9昆蟲細(xì)胞培養(yǎng)物在首次傳代后的99h內(nèi)的活力變化���。
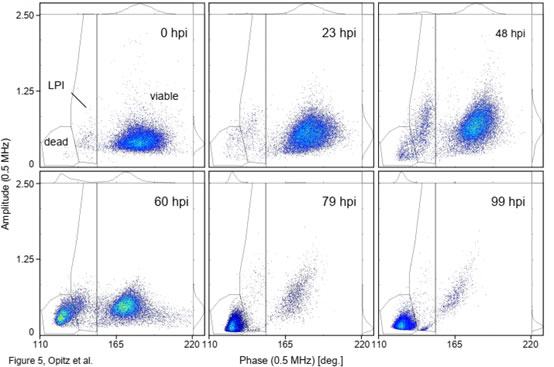
圖5 感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞活性的變化
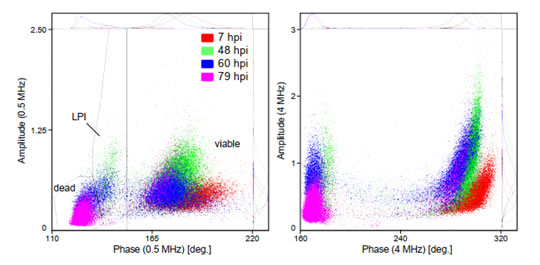
圖S4 感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞活性相位疊加圖上圖為Sf9昆蟲細(xì)胞在感染桿狀病毒后的數(shù)小時(shí)(hpi)內(nèi),相位-振幅散點(diǎn)圖的變化(0hpi為感染前的參考培養(yǎng)物)���。在BV感染從0到99 hpi的整個(gè)過程中��,相位-振幅散點(diǎn)圖的可明顯分離出三個(gè)細(xì)胞類群�����,分為是活細(xì)胞(viable)���、感染晚期(LPI)和死細(xì)胞(dead)類群(圖5)�����。類似于酵母(圖1)����,在較高的相位值(150?到220?)下分離出“活”細(xì)胞類群�����。這部分活細(xì)胞在感染后的0-48hpi��,阻抗振幅增加了約60%��,這與感染后細(xì)胞的“膨脹”狀態(tài)相一致��。阻抗振幅的變化提供了感染水平的定量讀數(shù)�����,可用于從病毒滴定分析中確定病毒與細(xì)胞比率(感染多重性��,MOI)。48hpi后���,活細(xì)胞的阻抗振幅降低(細(xì)胞萎縮)且數(shù)量逐漸減少��,直至99hpi細(xì)胞全部死亡(見圖6)��。感染晚期(LPI)細(xì)胞類群出現(xiàn)在較低相位�����,這部分細(xì)胞在0-60hpi逐漸增加隨后減少直至消失����,這是由于感染后期的細(xì)胞裂解所致�。
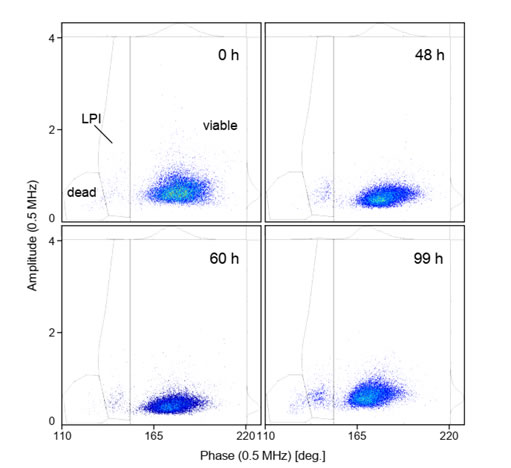
圖S3 未感染桿狀病毒(BV)的Sf9昆蟲細(xì)胞活性的變化上圖為未感染桿狀病毒(BV)的Sf9昆蟲細(xì)胞活性的變化,同感染細(xì)胞一致��,相位-振幅散點(diǎn)圖也可分離出活細(xì)胞(viable)�����、感染晚期(LPI)和死細(xì)胞(dead)類群����。如圖所示,細(xì)胞活力(97.9 %±0.7 %)在79 hpi的連續(xù)生長(zhǎng)過程中始終保持不變�����。僅當(dāng)在99 hpi超過典型的繼代間隔時(shí)間時(shí)�����,細(xì)胞活力下降至約93.1%��,這可能是由于營(yíng)養(yǎng)限制或細(xì)胞密度過高所致�����。與感染的Sf9昆蟲細(xì)胞的相位-振幅散點(diǎn)圖(圖5)相比�,未感染細(xì)胞的振幅分布(與細(xì)胞大小相關(guān))在0-60h內(nèi)略有變窄,而直到60h才明顯檢測(cè)到LPI(感染晚期)細(xì)胞類群�����,到99h時(shí)該類群略有增加�����。感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞活力和重組蛋白表達(dá)的時(shí)間動(dòng)力學(xué)變化本文除利用IFC法���、臺(tái)盼藍(lán)染色鏡檢法追蹤了感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞活性的動(dòng)力學(xué)變化���,還同時(shí)利用綠色熒光蛋轉(zhuǎn)染Sf9細(xì)胞以量化重組蛋白的產(chǎn)量�,下圖為感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞活力和重組蛋白表達(dá)的時(shí)間動(dòng)力學(xué)變化�。
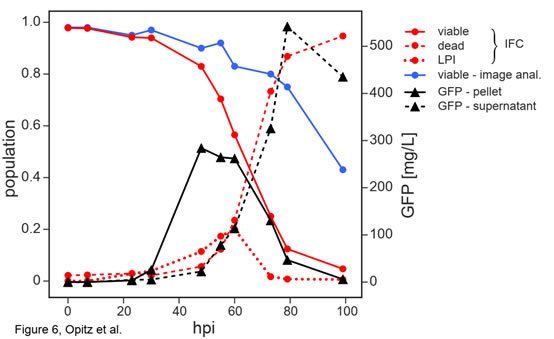
圖6 感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞活力和重組蛋白表達(dá)的時(shí)間動(dòng)力學(xué)變化結(jié)果表明,在感染BV后的24hpi內(nèi)�����,IFC法與臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器的檢測(cè)結(jié)果高度一致����;24-60hpi內(nèi),IFC法檢測(cè)到的活性快速下降到50%(紅實(shí)線)�,而臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器檢測(cè)到的細(xì)胞活性下降緩慢,僅從100%下降到80%(藍(lán)實(shí)線)���;從60hpi后����,細(xì)胞活性均快速下降�,但到99hpi時(shí)����,IFC法的檢測(cè)結(jié)果僅為5%�����,而臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器的檢測(cè)結(jié)果為42%����;整個(gè)測(cè)試過程中��,兩者差異在79hpi時(shí)達(dá)到最大�����,分別為11%和78%�。79hpi的相位-振幅散點(diǎn)圖(圖5)表明此時(shí)IFC法可以準(zhǔn)確捕捉到細(xì)胞阻抗信號(hào)發(fā)生了巨大變化(細(xì)胞的大規(guī)模重組),而臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器卻不能及時(shí)檢測(cè)到這一變化���。感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞大小的變化在BV感染的不同階段���,細(xì)胞大小有顯著差異。因此��,臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)法通常用細(xì)胞大小表征BV感染的狀態(tài)和重組蛋白的產(chǎn)量質(zhì)量。如圖7所示���,在23-60 hpi之間�,感染細(xì)胞從最初的12.8μm膨脹到約16μm��,然后在99 hpi時(shí)最終縮減到8.5μm(圖7A�����,紅色虛線)��。這與IFC法獲得的平均振幅(圖7A�����,黑色虛線)的變化趨勢(shì)非常相似�,分析表明,振幅數(shù)據(jù)與平均細(xì)胞大小有很好的相關(guān)性(R2=0.901)(圖7B)����。也就是說IFC法不僅可以評(píng)估細(xì)胞的活力,還可以評(píng)估細(xì)胞的大小�����。
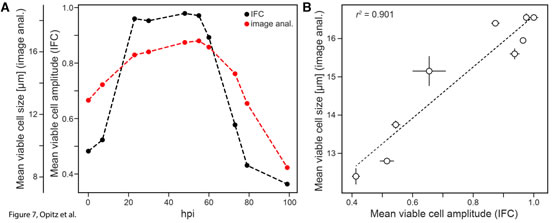
圖7 感染桿狀病毒(BV)后的Sf9昆蟲細(xì)胞大小的變化LPI(感染晚期)類群大小與重組蛋白產(chǎn)量的關(guān)系相較于臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)法,IFC法可進(jìn)一步將失活細(xì)胞區(qū)分為感染晚期(LPI)和死細(xì)胞(dead)兩個(gè)類群(圖5)��。隨感染時(shí)間的延長(zhǎng)�,LPI類群的細(xì)胞在48-60 hpi內(nèi)逐漸增多�����,到72 hpi幾乎全部消失�����。這一類群的大小與裂解細(xì)胞中檢測(cè)到的表達(dá)trGFPuv的濃度相關(guān)(圖6���,紅色虛線和黑色實(shí)線)��。隨著BV感染的進(jìn)一步發(fā)展����,表達(dá)的trGFPuv隨細(xì)胞裂解釋放到培養(yǎng)基中(圖6����,黑色虛線),其濃度的變化與IFC確定的死亡細(xì)胞總數(shù)的比例完全一致(圖6���,紅色虛線)�����。盡管細(xì)胞外表達(dá)的trGFPuv的數(shù)量最終會(huì)超過細(xì)胞內(nèi)的trGFPuv��,但培養(yǎng)基中的不必要反應(yīng)和裂解細(xì)胞釋放的蛋白酶可能會(huì)降低表達(dá)蛋白的質(zhì)量����,因此研究者并不希望將這部分釋放的蛋白質(zhì)用于后續(xù)應(yīng)用。由于IFC法檢測(cè)到的LPI群體與表達(dá)的胞內(nèi)蛋白密切相關(guān)���,因此利用Ampha Z32(IFC)可以很好地預(yù)測(cè)胞內(nèi)蛋白的理想收獲時(shí)間�����。以上研究表明��,Ampha Z32(IFC)微流控阻抗流式細(xì)胞儀是一種快速�����、可靠�����、無標(biāo)記的細(xì)胞活力檢測(cè)技術(shù)��。不僅可以在發(fā)酵過程中可靠測(cè)定細(xì)胞活力���,細(xì)胞大小的變化���,評(píng)估培養(yǎng)條件����;還可以在昆蟲細(xì)胞bv感染過程中篩選理想的表達(dá)條件、病毒滴度��,預(yù)測(cè)BV昆蟲細(xì)胞系統(tǒng)中獲得胞內(nèi)蛋白的理想時(shí)間���,可廣泛應(yīng)用于微生物和動(dòng)物單細(xì)胞的培養(yǎng)中�����。


















